Resumo das Características do Medicamento
NOME DO MEDICAMENTO VETERINÁRIO
Metrotab vet. Flavoured 250 mg Comprimidos para cães e gatos
Metrotab vet. Flavoured 500 mg Comprimidos para cães e gatos
Metrotab vet. Flavoured 1000 mg Comprimidos para cães
COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido de METROTAB 250mg contém:
Substância ativa: Metronidazol 250 mg
Cada comprimido de METROTAB 500mg contém:
Substância ativa: Metronidazol 500 mg
Cada comprimido de METROTAB 1.000mg contém:
Substância ativa: Metronidazol 1.000 mg
Excipientes: Para a lista completa de excipientes, ver “Lista de Excipientes”.
FORMA FARMACÊUTICA
Comprimido.
Comprimido aromatizado branco-pérola a castanho-claro, com manchas castanhas, redondo e convexo, com uma linha de quebra unilateral em forma de cruz.
Os comprimidos podem ser divididos em 2 ou 4 partes iguais.
INFORMAÇÕES CLÍNICAS
Espécie(s)-alvo
Caninos (cães) e felinos (gatos) – METROTAB 250 MG e METROTAB 500MG.
Caninos (cães) – METROTAB 1.000 MG
Indicações de utilização, especificando as espécies-alvo
Tratamento das infeções do trato gastrointestinal causadas por espécies Giardia e espécies Clostridia spp. (isto é, C. perfringens ou C. difficile).
Tratamento das infeções do trato urogenital, cavidade oral, garganta e pele causadas por bactérias anaeróbias obrigatórias (por ex., espécies Clostridia spp.) sensíveis ao metronidazol.
Contraindicações
Não administrar em caso de doenças hepáticas.
Não administrar em caso de hipersensibilidade conhecida à substância ativa ou a algum dos excipientes.
Advertências especiais para cada espécie-alvo
Não existem.
Precauções especiais de utilização
Precauções especiais para a utilização em animais
Devido à provável variabilidade (temporal, geográfica) na ocorrência de bactérias resistentes a metronidazol, recomenda-se a realização de testes de amostragem e sensibilidade bacteriológicas. Sempre que possível, o medicamento veterinário só deve ser administrado com base em testes de sensibilidade. As políticas antimicrobianas oficiais, nacionais e regionais devem ser consideradas ao administrar o medicamento veterinário.
Podem ocorrer sinais neurológicos, especialmente após tratamento prolongado com metronidazol. Como os comprimidos são aromatizados, conservar os comprimidos fora do alcance dos animais para evitar a ingestão acidental. Precauções especiais a adotar pela pessoa que administra o medicamento veterinário aos animais. Confirmou-se que o metronidazol tem propriedades mutagénicas e genotóxicas em animais de laboratório, bem como em seres humanos. Confirmou-se que o metronidazol é carcinogénico em animais de laboratório e tem possivelmente efeitos carcinogénicos em seres humanos. Contudo, não há evidências adequadas quanto à carcinogenicidade do metronidazol em seres humanos.
O metronidazol pode ser nocivo para o nascituro.
As mulheres grávidas devem ter cuidado ao manusear este medicamento veterinário.
Devem-se usar luvas impermeáveis durante a administração do medicamento veterinário, para evitar o respetivo contacto com a pele e com a boca através das mãos.
Para evitar a ingestão acidental, particularmente por uma criança, as partes não administradas de um comprimido devem ser recolocadas no espaço de blister aberto, reintroduzidas no acondicionamento secundário e conservadas num lugar seguro, fora da vista e do alcance das crianças. Em caso de ingestão acidental, dirija-se imediatamente a um médico e mostre-lhe o folheto informativo ou o rótulo.
O metronidazol poderá causar reações de hipersensibilidade. Em caso de hipersensibilidade conhecida a metronidazol, evitar o contacto com o medicamento veterinário.
Lavar bem as mãos depois de manusear os comprimidos.
Reações adversas (frequência e gravidade)
Podem ocorrer as seguintes reações adversas após a administração de metronidazol: vómitos, hepatotoxicidade e neutropénia. Em casos muito raros podem ocorrer sinais neurológicos. No cão, a ataxia (vestibulocerebelosa) e o nistagmo (vertical) encontraram-se entre os sinais neurológicos mais frequentemente notificados.
A frequência dos eventos adversos é definida utilizando a seguinte convenção:
- muito frequente (mais de 1 em 10 animais tratados apresentando evento(s) adverso(s));
- frequente (mais de 1 mas menos de 10 animais em 100 animais tratados);
- pouco frequente (mais de 1 mas menos de 10 animais em 1.000 animais tratados);
- rara (mais de 1 mas menos de 10 animais em 10.000 animais tratados);
- muito rara (menos de 1 animal em 10.000 animais tratados, incluindo notificações isoladas).
Utilização durante a gestação, a lactação ou a postura de ovos
Gestação
Os estudos realizados em animais de laboratório produziram resultados inconsistentes relativamente aos efeitos teratogénicos/embriotóxicos do metronidazol. Portanto, a administração deste medicamento veterinário não é recomendada durante a gestação.
Lactação
O metronidazol é excretado no leite e, portanto, a administração não é recomendada durante a lactação.
Interações medicamentosas e outras formas de interação
O metronidazol pode ter um efeito inibitório na degradação de outros medicamentos no fígado, como a fenitoína, a ciclosporina e a varfarina.
A cimetidina pode reduzir o metabolismo hepático do metronidazol, resultando no aumento da concentração sérica de metronidazol.
O fenobarbital pode aumentar o metabolismo hepático do metronidazol, resultando na redução da concentração sérica de metronidazol.
Posologia e via de administração
Via oral.
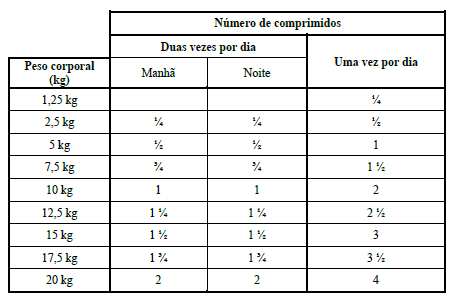
METROTAB 250 MG
A dose recomendada é de 50 mg de metronidazol por kg de peso corporal (um comprimido de 250 mg/5 kg de peso corporal) por dia, durante 5 – 7 dias. A dose diária deve ser preferencialmente dividida em duas doses iguais para administração duas vezes por dia (isto é, 25 mg/kg de peso corporal duas vezes por dia).
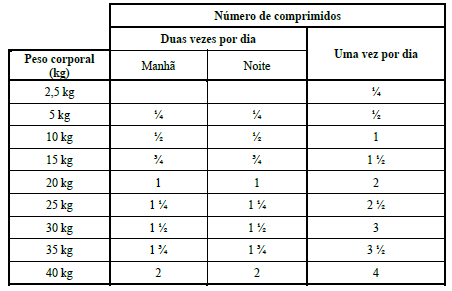
METROTAB 500 MG
A dose recomendada é de 50 mg de metronidazol por kg de peso corporal (um comprimido de 500 mg/10 kg de peso corporal) por dia, durante 5 – 7 dias. A dose diária deve ser preferencialmente dividida em duas doses iguais para administração duas vezes por dia (isto é, 25 mg/kg de peso corporal duas vezes por dia).
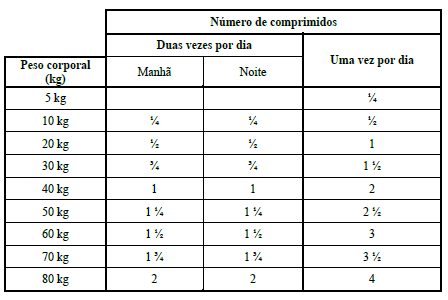
METROTAB 1.000 MG
A dose recomendada é de 50 mg de metronidazol por kg de peso corporal (um comprimido de 1000 mg/20 kg de peso corporal) por dia, durante 5 – 7 dias. A dose diária deve ser preferencialmente dividida em duas doses iguais para administração duas vezes por dia (isto é, 25 mg/kg de peso corporal duas vezes por dia).
Para assegurar a administração da dosagem correta, deve-se determinar o peso corporal tão exatamente quanto possível.
Os comprimidos podem ser divididos em 2 ou 4 partes iguais, para assegurar uma dosagem exata. Coloque o comprimido numa superfície plana, com o lado da linha virado para cima e o lado convexo (arredondado) virado para a superfície.
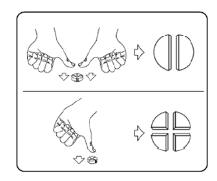
Metades: pressione com os polegares ou dedos em ambos os lados do comprimido.
Quartos: pressione com o polegar ou um dedo no meio do comprimido.
Os comprimidos divididos devem ser utilizados na próxima administração. Quaisquer comprimidos divididos restantes após a última administração do medicamento veterinário devem ser eliminados.
Sobredosagem (sintomas, procedimentos de emergência, antídotos), (se necessário)
A ocorrência de acontecimentos adversos é mais provável com doses e durações de tratamento que excedam o regime de tratamento recomendado. Caso ocorram sinais neurológicos, o tratamento deve ser descontinuado e o doente deve ser tratado sintomaticamente. Foram descritos na literatura casos incidentais de cães com toxicose por metronidazol que foram tratados com êxito com diazepam, resultando num tempo de recuperação reduzido.
Intervalo(s) de segurança
Não aplicável.
PROPRIEDADES FARMACOLÓGICAS
Grupo farmacoterapêutico: Antiprotozoários contra doenças provocadas por protozoários, derivados de (nitro)imidazol
Código ATCvet: QP51AA01 metronidazol
Propriedades farmacodinâmicas
O metronidazol tem atividade antiprotozoária e antibacteriana. Após a penetração do metronidazol nas bactérias, a molécula é reduzida pelas bactérias sensíveis (anaeróbias). Os metabolitos criados têm um efeito tóxico nas bactérias através da ligação ao ADN bacteriano. Em geral, o metronidazol é bactericida para as bactérias sensíveis em concentrações iguais ou ligeiramente superiores à concentração inibitória mínima (CIM).
Propriedades farmacocinéticas
O metronidazol é imediatamente e bem absorvido após administração por via oral. Após 1 hora foi atingida uma concentração plasmática de 10 microgramas/ml com uma dose única de 50 mg. A biodisponibilidade do metronidazol é de quase 100% e a semivida no plasma é de aproximadamente 8–10 horas. O metronidazol penetra bem nos tecidos e fluidos corporais, como saliva, leite, secreções vaginais e sémen. O metronidazol é principalmente metabolizado no fígado. No prazo de 24 horas após a administração por via oral, 35%–65% da dose administrada (metronidazol e respetivos metabolitos) é excretada na urina.
INFORMAÇÕES FARMACÊUTICAS
Lista de excipientes
Celulose microcristalina
Glicolato de amido de sódio (tipo A)
Hidroxipropilcelulose
Sílica coloidal hidratada
Estearato de magnésio
Aroma a frango
Incompatibilidades principais
Não aplicável.
Prazo de validade
Prazo de validade do medicamento veterinário tal como embalado para venda: 30 meses.
Precauções especiais de conservação
Este medicamento veterinário não necessita de quaisquer precauções especiais de conservação.
Recolocar qualquer comprimido dividido no blister.
Natureza e composição do acondicionamento primário
Blister de alumínio/PVC/PE/PVDC em caixa de cartão
Apresentações:
Caixa de cartão com 2 blisters de 10 comprimidos
Caixa de cartão com 3 blisters de 10 comprimidos
Caixa de cartão com 5 blisters de 10 comprimidos
Caixa de cartão com 10 blisters de 10 comprimidos
É possível que não sejam comercializadas todas as apresentações.
Precauções especiais para a eliminação de medicamentos veterinários não utilizados ou de desperdícios derivados da utilização desses medicamentos
O medicamento veterinário não utilizado ou os seus desperdícios devem ser eliminados de acordo com os requisitos nacionais.
TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
CP-Pharma Handelsgesellschaft mbH
Ostlandring 13
31303 Burgdorf
Alemanha
NÚMERO(S) DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
1403/01/21DFVPT - 1403/02/21DFVPT - 1403/03/21DFVPT
DATA DA PRIMEIRA AUTORIZAÇÃO/RENOVAÇÃO DA AUTORIZAÇÃO
8 de Fevereiro de 2021
DATA DA REVISÃO DO TEXTO
Maio de 2021
PROIBIÇÃO DE VENDA, FORNECIMENTO E/OU UTILIZAÇÃO
Não aplicável.
