
Resumo das Características do Medicamento
1. NOME DO MEDICAMENTO VETERINÁRIO
Milteforan 20 mg/ml, solução oral para cães.
2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada ml contém:
Substância ativa:
Miltefosina ..... 20 mg
Excipiente(s):
Composição qualitativa dos excipientes e outros componentes
Hidroxipropilcelulose,
Propilenoglicol,
Água purificada.
Solução oral.
Solução viscosa incolor.
3. INFORMAÇÃO CLÍNICA
3.1 Espécies-alvo
Cães.
3.2 Indicações de utilização para cada espécie-alvo
Tratamento dos sinais clínicos da leishmaniose canina, causada por Leishmania infantum.
3.3 Contra-indicações
Não administrar em caso de hipersensibilidade à substância ativa, aos adjuvantes ou a algum dos excipientes.
3.4 Advertências especiais
Os sinais clínicos da doença começam a diminuir acentuadamente imediatamente após o início do tratamento e diminuem significativamente 2 semanas depois. Os sinais continuam a melhorar durante, pelo menos, 4 semanas após a conclusão do tratamento.
A leishmaniose canina é uma zoonose transmitida por flebotomíneos (Phlebotomus spp), na qual o cão atua como reservatório. Não é alcançado um efeito curativo com este medicamento veterinário e o parasita não é completamente eliminado dos gânglios linfáticos e outros tecidos dos cães tratados. O tratamento não erradica o parasita em cães e a doença pode ser fatal. Consequentemente, a eutanásia pode ser recomendada para um animal em mau estado geral e/ou quando o animal está próximo de uma pessoa imunocomprometida.
A prevenção deve ser uma abordagem integrada no maneio da leishmaniose canina. Insecticidas tópicos de ação prolongada (spot-on ou coleiras) devem ser aplicados em cães que vivem ou viajam para áreas endémicas e devem ser mantidos durante todo o período de risco de exposição potencial a/ou atividade de flebotomíneos.
Também é aconselhável manter o cão dentro de casa durante a temporada de flebotomíneos, do anoitecer ao amanhecer.
O uso desnecessário de medicamentos antiprotozoários ou o uso fora das instruções fornecidas no RCMV pode aumentar a pressão de resistência e levar à redução da eficácia. A decisão de utilizar o medicamento veterinário deve basear-se na confirmação do diagnóstico de leishmaniose em cada animal.
Foi relatada resistência de Leishmania infantum ou recidivas clínicas após tratamento com miltefosina em cães e em humanos.
Em caso de suspeita de resistência à miltefosina, o cão infetado deve ser tratado com insecticidas sistémicos ou tópicos apropriados se estiver em área endémica, a fim de reduzir o risco de propagação de parasitas resistentes.
Foi demonstrada resistência cruzada entre miltefosina e anfotericina B na Leishmania infantum.
A utilização deste medicamento veterinário deve ter em conta a informação local sobre a suscetibilidade dos parasitas alvo, quando disponível.
Recomenda-se uma investigação mais aprofundada dos casos de suspeita de resistência, utilizando um método de diagnóstico apropriado (por exemplo, PCR em tempo real). A resistência confirmada deve ser comunicada ao titular da autorização de introdução no mercado ou às autoridades competentes.
3.5 Precauções especiais de utilização
Precauções especiais para a utilização segura nas espécies-alvo:
Recomenda-se deitar o medicamento veterinário na ração do animal para garantir que o estômago não está vazio antes da administração e, consequentemente, para reduzir os efeitos adversos digestivos.
Utilização em cães com insuficiência hepática e cardíaca graves, de acordo com a avaliação de risco/benefício do médico veterinário.
Se suspeitar que sua cadela pode estar grávida, entre em contato com seu médico veterinário para aconselhamento antes de usar.
Precauções especiais a adotar pela pessoa que administra o medicamento veterinário aos animais:
Este medicamento veterinário pode causar irritação nos olhos e na pele. Evite o contato com a pele ou membranas mucosas (incluindo contato mão-boca) e contato com os olhos (incluindo contato mão-olho).
Use equipamento de proteção individual composto por luvas e óculos impermeáveis, ao manusear o medicamento veterinário. Em caso de contato acidental com a pele ou os olhos, lavar e enxaguar com água em abundância.
Se a irritação cutânea ou ocular persistir, consulte um médico e mostre-lhe o folheto informativo ou o rótulo.
Não permitir que cães tratados lambam as pessoas imediatamente após a ingestão do medicamento.
Foi relatado que a miltefosina é tóxica para o embrião e o feto e teratogénica em animais de laboratório.
O medicamento veterinário não deve ser administrado por mulheres grávidas, por mulheres que pretendam engravidar ou cujo estado de gravidez seja desconhecido.
A miltefosina pode causar efeitos adversos, particularmente no trato gastrointestinal após ingestão. Evite a ingestão acidental (incluindo o contato mão-boca), principalmente por crianças.
Feche o frasco imediatamente após o uso para evitar que as crianças tenham acesso ao conteúdo. Não deixe a seringa contendo solução à vista e ao alcance das crianças.
Para evitar que as crianças tenham acesso às seringas usadas, imediatamente após a utilização coloque a seringa na embalagem original. E volte a colocar o frasco e a seringa na embalagem exterior e guarde num local seguro, fora da vista e do alcance das crianças.
Evite o acesso de crianças à alimentação medicamentada do cão. Para evitar que as crianças tenham acesso à ração medicamentada do cão, despeje a seringa sobre uma parte da ração e espere até que o animal tenha consumido completamente a ração medicamentada, para então administrar o restante da ração. Administre o tratamento fora da vista e do alcance das crianças. Qualquer alimento medicamentado não consumido, deve ser removido imediatamente e a tigela bem lavada.
Em caso de ingestão acidental, procure imediatamente orientação médica e mostre-lhe o folheto informativo ou o rótulo.
Lave as mãos após o uso.
Precauções especiais para a proteção do ambiente:
Não aplicável.
3.6 Eventos adversos
Cães
Muito frequentes (>1 animal / 10 animais tratados): Vómitos*, diarreia*.
*Ocorre dentro de 5 a 7 dias após o início do tratamento e dura por um período de 1 a 2 dias. Esses efeitos foram reversíveis no final do tratamento, sem necessidade de terapia específica.
Caso estes efeitos secundários apareçam, informe imediatamente o médico veterinário. A administração simultânea de antieméticos pode reduzir o risco destes efeitos indesejados.
A notificação de eventos adversos é importante. Permite a monitorização contínua da segurança de um medicamento veterinário. As notificações devem ser enviadas, de preferência por um médico veterinário, ao titular da Autorização de Introdução no Mercado ou ao respetivo representante local ou à autoridade nacional competente através do sistema nacional de farmacovigilância veterinária. Para obter informações de contacto, consulte também a secção 16 do Folheto Informativo.
3.7 Utilização durante a gestação, a lactação ou a postura de ovos
Estudos laboratoriais em ratos e coelhos produziram evidências de efeitos teratogénicos (ratos), fetotóxicos, embriotóxicos e maternotóxicos, bem como efeitos na fertilidade de machos e fêmeas (ratos).
A segurança do medicamento veterinário não foi estabelecida durante a gestação, lactação e em animais reprodutores.
Gestação e lactação:
Administração não recomendada durante a gestação e a lactação.
Fertilidade:
Não administrar a animais reprodutores.
3.8 Interação com outros medicamentos e outras formas de interação
Desconhecidas.
3.9 Posologia e via de administração
Administração oral.
O medicamento veterinário deve ser administrado na dose de 2 mg/kg de peso corporal, correspondente a 1 ml de solução oral por 10 kg de peso corporal. O medicamento veterinário deve ser derramado sobre uma parte da ração e oferecido ao cão uma vez ao dia durante 28 dias. Uma vez que o animal tenha consumido completamente a ração medicamentada, o restante da refeição pode ser oferecido ao cão.
Estando o parasita também localizado nos tecidos profundos (medula óssea, gânglios linfáticos, baço, fígado), é crucial cumprir a duração do tratamento (28 dias) para garantir a eficácia do medicamento veterinário.
Para garantir uma dosagem correta, o peso corporal deve ser determinado com a maior precisão possível antes e durante o tratamento.
A subdosagem pode resultar numa utilização ineficaz e pode favorecer o desenvolvimento de resistência.
A solução oral é aplicada através da embalagem descrita abaixo:
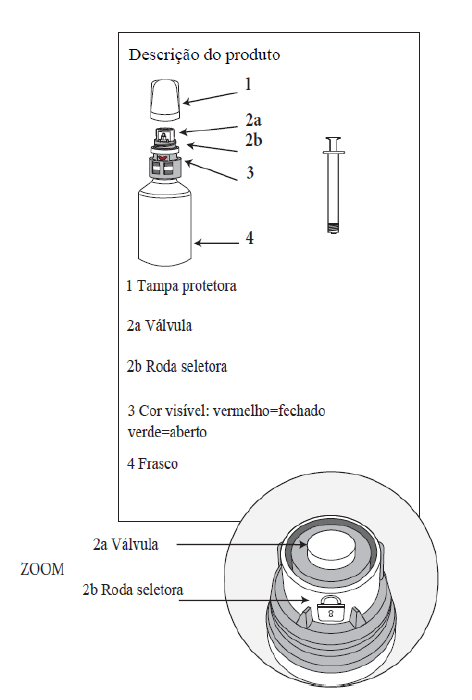
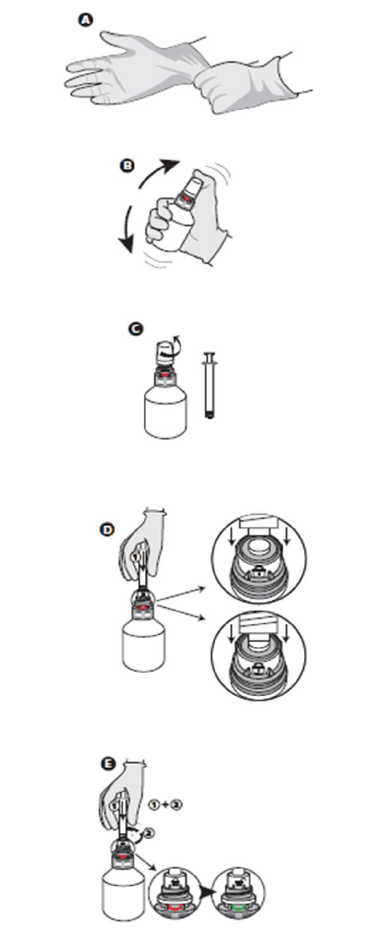
A. Use luvas de proteção antes de manusear o medicamento veterinário.
B. Agite vigorosamente o frasco antes de usar.
C. Desenrosque a tampa protetora.
D. Insira a seringa na parte superior branca da tampa (roda seletora) empurrando firmemente.
E. Enquanto empurra, gire a seringa para a direita (sentido horário) até aparecer o verde. 1 + 2 simultaneamente.
F. Colocar o volume correto do medicamento veterinário na seringa.
G. Desenrosque a seringa da tampa sem empurrar, girando-a para a esquerda (sentido anti-horário) até que o vermelho apareça novamente, depois continue girando para soltar a seringa. O sistema também pode ser fechado girando a roda seletora manualmente.
H. Enrosque novamente a tampa protetora. Adicione a dose recomendada à ração para cães. Recomenda-se deitar a dose sobre uma parte da ração do cão, esperar até que o animal tenha consumido completamente a ração medicamentada, para depois administrar o restante da ração.
Não lave a seringa.
Retire as luvas de proteção e guarde-as adequadamente.
Para garantir uma correta administração do medicamento veterinário, consulte os desenhos explicativos e o vídeo: https://player.vimeo.com/video/848683785?h=863f2b2f85
3.10 Sintomas de sobredosagem (e, quando aplicável, procedimentos de emergência e antídotos)
Um estudo de sobredosagem com, no máximo, o dobro da dose recomendada durante 28 dias, demonstrou a ocorrência de efeitos indesejáveis, tais como: vómitos incontroláveis.
3.11 Restrições especiais de utilização e condições especiais de utilização, incluindo restrições à utilização de medicamentos veterinários antimicrobianos e antiparasitários, a fim de limitar o risco de desenvolvimento de resistência
Não aplicável.
3.12 Intervalos de segurança
Não aplicável.
4. PROPRIEDADES FARMACOLÓGICAS
4.1 Código ATCvet: QP51DX07.
4.2 Propriedades farmacodinâmicas
A miltefosina possui atividade anti-leishmania in vitro e em modelos animais contra L. infantum.
Foi descrito que a miltefosina tem um efeito direto sobre os parasitas, interferindo na biossíntese de fosfolipídos e no metabolismo de alquil-lipídios, afetando as oxidases do citocromo C mitocondrial e induzindo a despolarização mitocondrial e a diminuição dos níveis intracelulares de ATP, e uma morte celular semelhante à apoptose.
A resistência da Leishmania infantum à miltefosina foi relatada em cães e em humanos. Foi demonstrada resistência cruzada entre miltefosina e anfotericina B na Leishmania infantum.
A resistência aos medicamentos pode ser devida a uma diminuição no acúmulo de miltefosina no parasita Leishmania, que se acredita ser devido a um aumento no efluxo do medicamento, mediado pela superexpressão da glicoproteína P do transportador ABC e/ou uma diminuição na captação do medicamento pela inativação do transporte de miltefosina que consiste no transportador de miltefosina e sua subunidade beta.
Mecanismos multifatoriais estão envolvidos na resistência natural à miltefosina em L. infantum, por ex. a ausência dos genes 3'nucleotidase/nuclease NUC1 e NUC2.
4.3 Propriedades farmacocinéticas
Após administração oral em cães, a miltefosina é quase completamente absorvida com uma biodisponibilidade absoluta de 94%. A miltefosina é caracterizada por uma semivida de eliminação lenta (t1/2 de 160 h) e baixa depuração plasmática (Cl = 0,04 ml/kg/min). Após uma primeira dose terapêutica de 2 mg/kg de peso corporal na alimentação dos cães, a concentração plasmática máxima (Cmax) é de cerca de 5.230 ng/mL com um Tmax de 6 horas.
Após administrações repetidas da dose terapêutica de 2 mg/kg de peso corporal por dia durante 28 dias na alimentação de cães, a Cmax é de cerca de 32.582 ng/ml e a AUC0-t é de 649.617 ng.h/ml após a última administração. Administrações repetidas do medicamento veterinário durante 28 dias conduzem a uma acumulação com um fator de 7,65.
A miltefosina é eliminada principalmente por via fecal e cerca de 10% da dose administrada é eliminada nas fezes, na sua forma inalterada. A eliminação da miltefosina pela via urinária é insignificante.
5. INFORMAÇÕES FARMACÊUTICAS
5.1 Incompatibilidades principais
Na ausência de estudos de compatibilidade, este medicamento veterinário não deve ser misturado com outros.
5.2 Prazo de validade
Prazo de validade do medicamento veterinário tal como embalado para venda: 3 anos.
Prazo de validade após a primeira abertura do acondicionamento primário: 12 semanas.
5.3 Precauções especiais de conservação
Este medicamento veterinário não necessita de quaisquer precauções especiais de conservação.
5.4 Natureza e composição do acondicionamento primário
Frasco de polietileno tereftalato (PET) equipado com tampa de amostragem de polipropileno (PP) com rolha de silicone e seringa de 3 ml de polipropileno (PP) graduada em 0,1 ml.
Caixa de cartão com um frasco para injetáveis de 30, 60 ou 90 ml e 1 seringa. É possível que não sejam comercializadas todas as apresentações.
5.5 Precauções especiais para a eliminação de medicamentos veterinários não utilizados ou de desperdícios derivados da utilização desses medicamentos
Os medicamentos não devem ser eliminados no lixo ou nos esgotos domésticos.
Utilize regimes de recolha de medicamentos veterinários para a eliminação de medicamentos veterinários não utilizados ou de resíduos resultantes da utilização desses medicamentos, em cumprimento dos requisitos nacionais e de quaisquer sistemas de recolha nacionais aplicáveis ao medicamento veterinário em causa.
6. NOME DO TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
VIRBAC.
7. NÚMERO(S) DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
AIM n.º 1621/01/24DFVPT.
8. DATA DA PRIMEIRA AUTORIZAÇÃO
Data da primeira autorização: 08/02/2024.
9. DATA DA ÚLTIMA REVISÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO VETERINÁRIO
02/2024.
10. CLASSIFICAÇÃO DOS MEDICAMENTOS VETERINÁRIOS
Medicamento veterinário sujeito a receita médico-veterinária.
Está disponível informação pormenorizada sobre este medicamento veterinário na base de dados de medicamentos da União Europeia Union Product Database (https://medicines.health.europa.eu/veterinary).
